Annex 11
Concept Paper
L’Annex 11 est une annexe à la
réglementation européenne
concernant les GMP (Good Manufacturing
Practices), volume 4 de l’Eudralex.
Elle définit les règles à respecter pour la validation des systèmes d’informations et sa
dernière révision date de 2011.
Elle répond à l’article 9 « Documentation » – Point 2 de la directive européenne 2003/94/CE
datant du 08 octobre 2003.
Contenu de l’Annex 11 actuelle
L’Annex 11 fixe les règles concernant la validation et le maintien en état validé d’un système d’informations dans le cadre des GMP. Le premier point abordé est l’approche risque, il est également le postulat de base de cette annexe. Toute décision doit être basée sur le risque lié à la santé du patient, l’intégrité des données et la qualité du produit. Elle doit également être documentée. Les points abordés sont ensuite la qualification du personnel, des fournisseurs, les étapes incontournables lors de la validation initiale d’un système d’informations et pour maintenir cette validation une fois le système mis en production.
Comment utiliser l’Annex 11
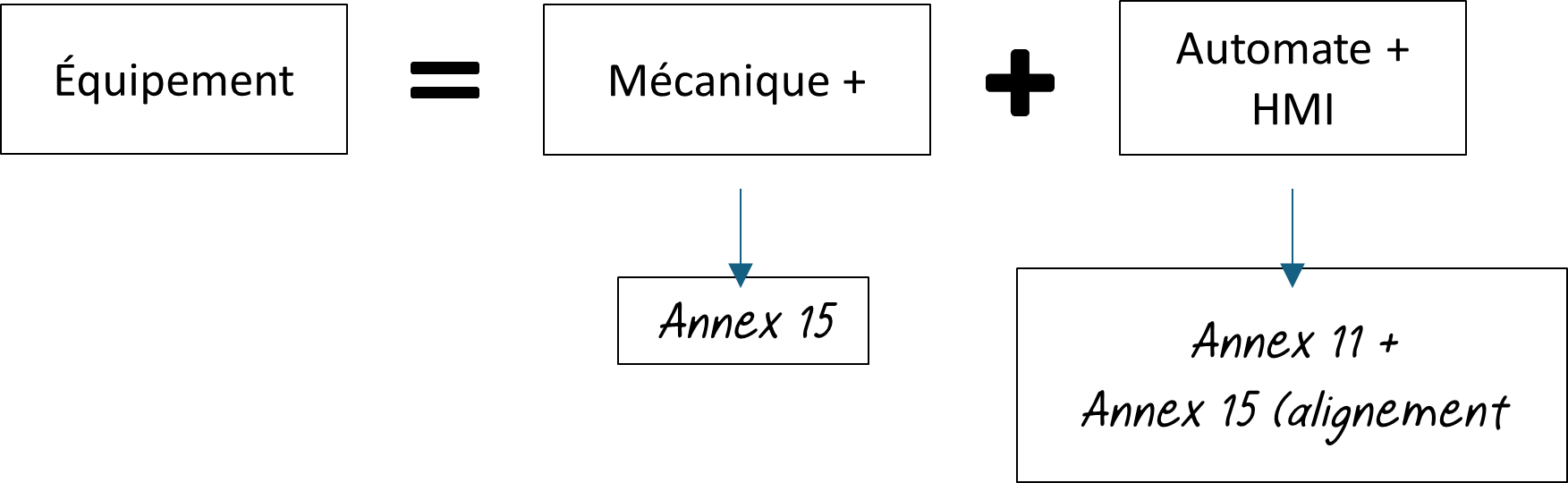
Il faut aborder l’Annex 11 conjointement à l’ICH Q9 (R1) qui décrit plus en détail l’approche risque exigée, mais aussi avec l’Annex 15 qui décrit les exigences liées à la qualification et la validation. Ainsi la qualification et la validation d’un équipement piloté par un automate et un écran de supervision s’articule d’un point de vue réglementaire selon le schéma suivant :
l’Annex 11 et la 21 CFR Part 11
L’Annex 11 est donc liée aux GMP, volume 4 de l’Eudralex et donc s’applique pour l’Europe. La 21 CFR Part 11 est quant à elle liée aux GMP, 21 CFR Part 210 et 211 de la FDA (Food & Drug Administration) et donc s’applique aux USA. Alors que la 21 CFR Part 11 cible essentiellement les enregistrements et les signatures électroniques dès lors qu’une donnée critique devient digitale, l’Annex 11 a une approche plus large car elle englobe la validation d’un SI sur l’ensemble de son cycle de vie. En revanche, dans les 2 réglementations, l’approche risque est préconisée et il est clairement spécifié que le remplacement d’une opération manuelle par un SI ne doit pas diminuer la qualité du produit et l’intégrité des données ou augmenter le risque lié au patient.
Le concept paper de l’Annex 11
La dernière révision de l’Annex 11 date de
2011. Afin de
répondre aux développements technologiques
et d’adapter la réglementation à ces nouveaux enjeux, l’EMA (Agence européenne des médicaments) a
publié en 2022 un concept paper de 5 pages sur la révision de l'annexe 11 des lignes directrices sur
les bonnes pratiques de fabrication pour les médicaments - Systèmes informatisés.
Ce concept paper qui s’articule autour de 33 points basés sur la structure et les chapitres de
l’Annex 11 existante présente les nouveautés à inclure mais aussi les sujets à mettre à jour.
Quels sont les points à ajouter ?
-
Le questionnaire et réponse (Annex 11 et intégrité des données) sur le site de l’EMA doit être intégré dans la nouvelle révision
-
Ajout d’exigences sur « data in motion » and « data at rest »
-
Ajout d’exigences sur le sujet de « Digital Transformation »
-
Ajout d’exigences sur l’intelligence artificielle « IA »
-
Ajout des aspects apparaissant dans la guidance de la FDA sur le CSA (Computer System Assurance)
-
Le scope d’application actuel de l’Annex 11 « where a computerized system replaces of a manual operation » est élargi à « another system or a manual process ».
Quels sont les points à adapter ?
-
Pour les fournisseurs de service pour les hébergements ou applications dans le cloud, l’utilisateur réglementé devra avoir accès à la documentation de validation du fournisseur
-
Les projets en mode Agile devrait être intégrés
-
Les données et systèmes critiques seront classifiés
-
Les exigences concernant l’audit trail deviennent beaucoup plus conséquentes (audit trail non modifiable, la fréquence des revues doit être justifiée, ….
-
Les contrôles pour la sécurité des accès et des données seront décrits plus en détail. La cybersécurité sera également abordée dans la nouvelle réglementation
L’Annex 11, l’Annex 15 et l’ICH Q9 (R1) dans leur révision actuelle décrivent les points réglementaires nécessaires afin d’aborder les défis liés aux nouvelles technologies telle que l’IA ou la gestion de projet en mode Agile et le GAMP®5 2nd apporte les réponses nécessaires pour répondre à ces exigences. L’Annex 11 peut être revue pour intégrer des corrections ou des ajustements mineurs, mais il faut être vigilant par rapport à une mise en œuvre trop détaillée qui rendrait sa mise en œuvre moins flexible ou un gros travail de remédiation pour les industries réglementées.
Le draft de l’Annex 11 est annoncé pour décembre 2024, mais un retard et une diffusion pour le premier trimestre de 2025 semble envisageable. Il sera consultable pour commentaires pendant 3 mois et UMEO y sera vigilant. Nous publierons un nouvel article afin de vous présenter notre revue.